Micropéptido
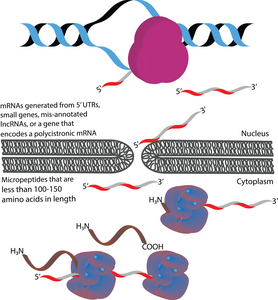
Los micropéptidos (también conocidos como microproteínas) son péptidos con una longitud de menos de 100 a 150 aminoácidos que están codificados por marcos de lectura abiertos cortos (sORF).[1] [2] [3] En este sentido, se diferencian de muchos otros polipéptidos pequeños activos, que se producen mediante la escisión postraduccional de polipéptidos más grandes.[1] [4] En términos de tamaño, los micropéptidos son considerablemente más cortos que las proteínas "canónicas", que tienen una longitud promedio de 330 y 449 aminoácidos en procariotas y eucariotas, respectivamente.[5] A veces los micropéptidos reciben nombres según su ubicación genómica. Por ejemplo, el producto traducido de un marco de lectura abierto ascendente (uORF) podría denominarse péptido codificado por uORF (uPEP).[6] Los micropéptidos carecen de secuencias de señalización N-terminal, lo que sugiere que es probable que estén localizados en el citoplasma.[1] Sin embargo, se han encontrado algunos micropéptidos en otros compartimentos celulares, como lo indica la existencia de micropéptidos transmembrana.[7] [8] Se encuentran tanto en procariotas como en eucariotas.[1] [9] [10] Los sORF a partir de los cuales se traducen los micropéptidos pueden codificarse en 5'UTR, genes pequeños o ARNm policistrónicos. Algunos genes codificadores de micropéptidos originalmente estaban mal anotados como ARN largos no codificantes (lncRNA).[11]
Dado su pequeño tamaño, los sORF fueron pasados por alto originalmente. Sin embargo, se han identificado cientos de miles de supuestos micropéptidos mediante diversas técnicas en multitud de organismos. Sólo una pequeña fracción de estos con potencial codificante han confirmado su expresión y función. Aquellos que han sido caracterizados funcionalmente, en general, tienen funciones en la señalización celular, la organogénesis y la fisiología celular. A medida que se descubren más micropéptidos, también se descubren más funciones. Una función reguladora es la de los peptointerruptores, que inhiben la expresión de secuencias codificantes posteriores al detener los ribosomas, a través de su activación directa o indirecta por moléculas pequeñas.[11]
Identificación[editar]
Existen varias técnicas experimentales para identificar potenciales ORF y sus productos traslacionales. Estas técnicas sólo son útiles para la identificación de sORF que pueden producir micropéptidos y no para la caracterización funcional directa.
Secuenciación de ARN[editar]
Un método para encontrar posibles sORF y, por lo tanto, micropéptidos, es mediante la secuenciación de ARN (RNA-Seq). RNA-Seq utiliza secuenciación de próxima generación (NGS) para determinar qué ARN se expresan en una célula, tejido u organismo determinado en un momento específico. Esta recopilación de datos, conocida como transcriptoma, se puede utilizar como recurso para encontrar posibles sORF.[1] Debido a la gran probabilidad de que sORF menores de 100 aminoácidos ocurran por casualidad, se necesitan más estudios para determinar la validez de los datos obtenidos utilizando este método.[11]
Perfilado de ribosomas (Ribo-Seq)[editar]
El perfilado de ribosomas se ha utilizado para identificar micropéptidos potenciales en un número creciente de organismos, incluidos moscas de la fruta, pez cebra, ratones y humanos. [11] Un método utiliza compuestos como harringtonina, puromicina o lactimidomicina para detener los ribosomas en los sitios de inicio de la traducción.[12] Esto indica dónde se está llevando a cabo la traducción activa. También se pueden usar inhibidores del alargamiento de la traducción, como emetina o cicloheximida, para obtener huellas de ribosomas que tienen más probabilidades de dar como resultado un ORF traducido. [13] Si un ribosoma está unido a un sORF o cerca de él, supuestamente codifica un micropéptido.[1] [2] [14]
Espectrometría de masas[editar]
La espectrometría de masas (MS) es el estándar de oro para identificar y secuenciar proteínas. Utilizando esta técnica, los investigadores pueden determinar si los polipéptidos, de hecho, se traducen a partir de un sORF.
Aplicaciones proteogenómicas[editar]
La proteogenómica combina proteómica, genómica y transciptómica. Esto es importante cuando se buscan micropéptidos potenciales. Un método de uso de la proteogenómica implica el uso de datos de RNA-Seq para crear una base de datos personalizada de todos los polipéptidos posibles. Se realiza cromatografía líquida seguida de MS en tándem (LC-MS/MS) para proporcionar información de secuencia para los productos de traducción. Se puede utilizar la comparación de los datos transcriptómicos y proteómicos para confirmar la presencia de micropéptidos.[1] [2]
Conservación filogenética[editar]
La conservación filogenética puede ser una herramienta útil, particularmente cuando se examina una gran base de datos de sORF. La probabilidad de que un sORF dé como resultado un micropéptido funcional es mayor si se conserva en numerosas especies.[11] [12] Sin embargo, esto no funcionará para todos los sORF. Por ejemplo, aquellos que están codificados por lncRNA tienen menos probabilidades de conservarse dado que los lncRNA en sí no tienen una alta conservación de secuencia.[2] Será necesaria más experimentación para determinar si realmente se produce un micropéptido funcional.
Validación del potencial de codificación de proteínas[editar]
Anticuerpos[editar]
Los anticuerpos personalizados dirigidos al micropéptido de interés pueden resultar útiles para cuantificar la expresión o determinar la localización intracelular. Como ocurre con la mayoría de las proteínas, una baja expresión puede dificultar la detección. El pequeño tamaño del micropéptido también puede generar dificultades a la hora de diseñar un epítopo a partir del cual apuntar al anticuerpo.[2]
Etiquetado con CRISPR-Cas9[editar]
La edición del genoma se puede utilizar para agregar FLAG/MYC u otras etiquetas peptídicas pequeñas a un sORF endógeno, creando así proteínas de fusión. En la mayoría de los casos, este método es beneficioso porque se puede realizar más rápidamente que desarrollar un anticuerpo personalizado. También es útil para micropéptidos a los que no se puede dirigir ningún epítopo.[2]
Traducción in vitro[editar]
Este proceso implica clonar el ADNc del micropéptido de longitud completa en un plásmido que contiene un promotor T7 o SP6. Este método utiliza un sistema de síntesis de proteínas libre de células en presencia de 35 S-metionina para producir el péptido de interés. A continuación, los productos pueden analizarse mediante electroforesis en gel y el péptido marcado con 35 S se visualiza mediante autorradiografía.[2]
Bases de datos y repositorios[editar]
Hay varios repositorios y bases de datos que se han creado tanto para sORF como para micropéptidos. Puede encontrar un repositorio de pequeños ORF descubiertos mediante la elaboración de perfiles de ribosomas en sORFs.org.[15] [16] En ARA-PEP se puede encontrar un depósito de supuestos péptidos codificados por sORF en Arabidopsis thaliana,[17] [18] En SmProt se puede encontrar una base de datos de proteínas pequeñas, especialmente codificadas por ARN no codificantes.[19] [20]
Ejemplos de procarióticos[editar]
Hasta la fecha, la mayoría de los micropéptidos se han identificado en organismos procarióticos. Si bien la mayoría aún no se ha caracterizado completamente, de los que se han estudiado, muchos parecen ser críticos para la supervivencia de estos organismos. Debido a su pequeño tamaño, los procariotas son particularmente susceptibles a los cambios en su entorno y, como tales, han desarrollado métodos para asegurar su existencia.
Escherichia coli (E. coli)[editar]
Los micropéptidos expresados en E. coli ejemplifican adaptaciones ambientales bacterianas. La mayoría de ellos se han clasificado en tres grupos: péptidos líderes, proteínas ribosómicas y proteínas tóxicas. Las proteínas líderes regulan la transcripción y/o traducción de proteínas involucradas en el metabolismo de los aminoácidos cuando los aminoácidos son escasos. Las proteínas ribosómicas incluyen L36 (rpmJ) y L34 (rpmH), dos componentes de la subunidad ribosómica 50S. Las proteínas tóxicas, como la ldrD, son tóxicas en niveles elevados y pueden matar células o inhibir el crecimiento, lo que reduce la viabilidad de la célula huésped.[21]
Salmonella entérica (S. enterica)[editar]
En S. enterica, el factor de virulencia MgtC participa en la adaptación a ambientes bajos en magnesio. El péptido hidrofóbico MgrR, se une a MgtC, provocando su degradación por la proteasa FtsH.[9]
Bacilo subtilis (B. subtilis)[editar]
El micropéptido Sda de 46 aa, expresado por B. subtilis, reprime la esporulación cuando se altera el inicio de la replicación. Al inhibir la histidina quinasa KinA, Sda previene la activación del factor de transcripción Spo0A, que es necesario para la esporulación.[10]
Estafilococo aureus (S. aureus)[editar]
En S. aureus, hay un grupo de micropéptidos, de 20 a 22 aa, que se excretan durante la infección del huésped para alterar las membranas de los neutrófilos y provocar la lisis celular. Estos micropéptidos permiten a la bacteria evitar la degradación por parte de las principales defensas del sistema inmunológico humano.[22] [23]
Ejemplos eucariotas[editar]
Se han descubierto micropéptidos en organismos eucariotas, desde Arabidopsis thaliana hasta humanos. Desempeñan diversas funciones en el desarrollo de tejidos y órganos, así como en el mantenimiento y función una vez completamente desarrollados. Si bien muchos aún no se han caracterizado funcionalmente y es probable que queden más por descubrir, a continuación, se muestra un resumen de las funciones de micropéptidos eucariotas identificadas recientemente.
Arabidopsis thaliana (A. thaliana )[editar]
El gen POLARIS (PLS) codifica un micropéptido de 36 aa. Es necesario para el patrón vascular adecuado de las hojas y la expansión celular en la raíz. Este micropéptido interactúa con las proteínas PIN del desarrollo para formar una red crítica para la interferencia hormonal entre auxina, etileno y citoquinina.[24] [25] [26]
ROTUNDIFOLIA (ROT4) en A. thaliana codifica un péptido de 53 aa, que se localiza en la membrana plasmática de las células de las hojas. El mecanismo de la función de ROT4 no se comprende bien, pero los mutantes tienen hojas cortas y redondeadas, lo que indica que este péptido puede ser importante en la morfogénesis de las hojas.[27]
Zea mays (Z. mays )[editar]
Brick1 (Brk1) codifica un micropéptido de 76 aa, que está altamente conservado tanto en plantas como en animales. En Z. mays, se encontró que estaba involucrado en la morfogénesis de los epitelios de las hojas, al promover múltiples eventos de polarización celular dependientes de actina en la epidermis de la hoja en desarrollo.[28] Zm401p10 es un micropéptido de 89 aa que desempeña un papel en el desarrollo normal del polen en el tapete. Después de la mitosis también es fundamental en la degradación del tapete.[29] Zm908p11 es un micropéptido de 97 aa de longitud, codificado por el gen Zm908 que se expresa en granos de polen maduros. Se localiza en el citoplasma de los tubos polínicos, donde ayuda en su crecimiento y desarrollo.[30]
Drosophila melanogaster (D. melanogaster )[editar]
El gen del arroz pulido (pri), conservado evolutivamente, conocido como sin tarso (tal) en D. melanogaster, está implicado en la diferenciación epidérmica. Este transcrito policistrónico codifica cuatro péptidos similares, que varían entre 11 y 32 aa de longitud. Su función es truncar el factor de transcripción Shavenbaby (Svb). Esto convierte a Svb en un activador que regula directamente la expresión de los efectores objetivos, incluidos la miniatura (m) y el shavenoide (sha), que son juntos responsables de la formación de tricomas.[31]
Danio rerio ( D.rerio )[editar]
El gen Elabela (Ela) (también conocido como Apela, niño pequeño) es importante para la embriogénesis.[32] Se expresa específicamente durante las etapas tardías de blástula y gástrula. Durante la gastrulación, es fundamental para promover la internalización y el movimiento dirigido por el polo animal de las células endodérmicas del mes. Después de la gastrulación, Ela se expresa en el mesodermo lateral, el endodermo, así como en la notocorda anterior y posterior. Aunque se anotó como lncRNA en pez cebra, ratón y humanos, se descubrió que el ORF de 58 aa estaba altamente conservado entre las especies de vertebrados. Ela se procesa mediante la eliminación de su péptido señal N-terminal y luego se secreta en el espacio extracelular. Su péptido maduro de 34 aminoácidos sirve como el primer ligando endógeno de un GPCR conocido como receptor de Apelina.[33] [32] La inactivación genética de Ela o Aplnr en el pez cebra da como resultado fenotipos sin corazón.[34] [35]
Mus musculus (M. musculus )[editar]
La miorregulina (Mln) está codificada por un gen originalmente anotado como lncRNA. Mln se expresa en los 3 tipos de músculo esquelético y funciona de manera similar a los micropéptidos fosfolambán (Pln) en el músculo cardíaco y sarcolipina (Sln) en el músculo esquelético lento (Tipo I). Estos micropéptidos interactúan con el retículo sarcoplásmico Ca 2+ -ATPasa (SERCA), una bomba de membrana responsable de regular la absorción de Ca 2+ en el retículo sarcoplásmico (SR). Al inhibir la absorción de Ca 2+ en el SR, provocan relajación muscular. De manera similar, los genes de la endorregulina (ELN) y otra regulina (ALN) codifican micropéptidos transmembrana que contienen el motivo de unión SERCA y se conservan en los mamíferos.[7]
Myomixer (Mymx) está codificado por el gen Gm7325, un péptido específico del músculo, de 84 aa de longitud, que desempeña un papel durante la embriogénesis en la fusión y la formación del músculo esquelético. Se localiza en la membrana plasmática y se asocia con una proteína de membrana fusogénica, Myomaker (Mymk). En humanos, el gen que codifica Mymx está anotado como LOC101929726 no caracterizado. También se encuentran ortólogos en los genomas de tortugas, ranas y peces.[8]
Homo sapiens (H. sapiens)[editar]
En humanos, NoBody (polipéptido disociador de cuerpos P no anotado), un micropéptido de 68 aa, se descubrió en el ARN no codificante (lincRNA) LINC01420 de intervención larga. Tiene una alta conservación de secuencia entre los mamíferos y se localiza en cuerpos P. Enriquece proteínas asociadas con la descapsulación del ARNm 5'. Se cree que interactúa directamente con Enhancer of mRNA Decapping 4 (EDC4).[36]
ELABELA (ELA) (también conocida como APELA) es una hormona endógena que las células madre embrionarias humanas secretan como un micropéptido de 32 aminoácidos. [32] Es fundamental mantener la autorrenovación y la pluripotencia de las células madre embrionarias humanas. Sus señales de forma autocrina a través de la vía PI3/AKT a través de un receptor de superficie celular aún no identificado.[37] En la diferenciación de las células mesoendérmicas, ELA se une y envía señales a través de APLNR, un GPCR que también puede responder al péptido hormonal APLN.
Se predice que el gen C7orf49, conservado en mamíferos, cuando se empalma alternativamente producirá tres micropéptidos. Anteriormente se descubrió que MRI-1 era un modulador de la infección por retrovirus. El segundo micropéptido previsto, MRI-2, puede ser importante en la unión de extremos no homólogos (NHEJ) de las roturas de doble cadena del ADN. En experimentos de co-inmunoprecipitación, MRI-2 se unió a Ku70 y Ku80, dos subunidades de Ku, que desempeñan un papel importante en la vía NHEJ.[38]
El micropéptido de 24 aminoácidos, Humanina (HN), interactúa con la proteína X asociada a Bcl2 (Bax), la proteína inductora de apoptosis. En su estado activo, Bax sufre un cambio conformacional que expone los dominios dirigidos a la membrana. Esto hace que se desplace desde el citosol a la membrana mitocondrial, donde se inserta y libera proteínas apoptogénicas como el citocromo c. Al interactuar con Bax, HN evita que Bax se dirija a las mitocondrias, bloqueando así la apoptosis.[39]
Se descubrió que un micropéptido de 90aa, ' pequeño polipéptido regulador de la respuesta a aminoácidos ' o SPAAR, estaba codificado en el lncRNA LINC00961 . Se conserva entre humanos y ratones y se localiza en el endosoma/lisosoma tardío. SPAAR interactúa con cuatro subunidades del complejo v-ATPasa, inhibiendo la translocación de mTORC1 a la superficie lisosomal donde se activa. La regulación negativa de este micropéptido permite la activación de mTORC1 mediante estimulación de aminoácidos, lo que promueve la regeneración muscular.[40]
Referencias[editar]
- ↑ a b c d e f g Crappé J, Van Criekinge W, Menschaert G. (2014). «Little things make big things happen: A summary of micropeptide encoding genes». EuPA Open Proteomics 3: 128-137. doi:10.1016/j.euprot.2014.02.006.
- ↑ a b c d e f g Makarewich CA, Olson EN. (2017). «Mining for Micropeptides». Trends in Cell Biology 27 (9): 685-696. PMC 5565689. PMID 28528987. doi:10.1016/j.tcb.2017.04.006.
- ↑ Guillén G, Díaz-Camino C, Loyola-Torres CA, Aparicio-Fabre R, Hernández-López A, Díaz-Sánchez M, Sanchez F. (2013). «Detailed analysis of putative genes encoding small proteins in legume genomes». Frontiers in Plant Science 4: 208. PMC 3687714. PMID 23802007. doi:10.3389/fpls.2013.00208.
- ↑ Hashimoto Y, Kondo T, Kageyama Y. (2008). «Lilliputians get into the limelight: novel class of small peptide genes in morphogenesis». Development, Growth & Differentiation 50 (Suppl 1): S269-76. PMID 18459982. doi:10.1111/j.1440-169x.2008.00994.x.
- ↑ Zhang J. (2000). «Protein-length distributions for the three domains of life». Trends in Genetics 16 (3): 107-9. PMID 10689349. doi:10.1016/s0168-9525(99)01922-8.
- ↑ Rothnagel J, Menschaert G. (2018). «Short Open Reading Frames and Their Encoded Peptides». Proteomics 18 (10): e1700035. PMID 29691985. doi:10.1002/pmic.201700035.
- ↑ a b Anderson DM, Anderson KM, Chang CL, Makarewich CA, Nelson BR, McAnally JR, Kasaragod P, Shelton JM, Liou J, Bassel-Duby R, Olson EN. (2015). «A micropeptide encoded by a putative long noncoding RNA regulates muscle performance». Cell 160 (4): 595-606. PMC 4356254. PMID 25640239. doi:10.1016/j.cell.2015.01.009.
- ↑ a b Bi P, Ramirez-Martinez A, Li H, Cannavino J, McAnally JR, Shelton JM, Sánchez-Ortiz E, Bassel-Duby R, Olson EN (2017). «Control of muscle formation by the fusogenic micropeptide myomixer». Science 356 (6335): 323-327. Bibcode:2017Sci...356..323B. PMC 5502127. PMID 28386024. doi:10.1126/science.aam9361.
- ↑ a b Alix E. , Blanc-Potard AB. (2008). «Peptide-assisted degradation of the Salmonella MgtC virulence factor». The EMBO Journal 27 (3): 546-557. PMC 2241655. PMID 18200043. doi:10.1038/sj.emboj.7601983.
- ↑ a b Burkholder WF, Kurtser I, Grossman AD. (2001). «Replication initiation proteins regulate a developmental checkpoint in Bacillus subtilis». Cell 104 (2): 269-79. PMID 11207367. doi:10.1016/s0092-8674(01)00211-2.
- ↑ a b c d e Andrews SJ, Rothnagel JA. (2014). «Emerging evidence for functional peptides encoded by short open reading frames». Nature Reviews. Genetics 15 (3): 193-204. PMID 24514441. doi:10.1038/nrg3520.
- ↑ a b Bazzini AA. , Johnstone TG. , Christiano R, Mackowiak SD, Obermayer B, Fleming ES, Vejnar CE, Lee MT, Rajewsky N, Walther TC. , Giraldez AJ. (2014). «Identification of small ORFs in vertebrates using ribosome footprinting and evolutionary conservation». The EMBO Journal 33 (9): 981-993. PMC 4193932. PMID 24705786. doi:10.1002/embj.201488411.
- ↑ Ingolia NT, Brar GA, Stern-Ginossar N, Harris MS, Talhouarne GJ, Jackson SE, Wills MR, Weissman JS. (2014). «Ribosome profiling reveals pervasive translation outside of annotated protein-coding genes». Cell Reports 8 (5): 1365-1379. PMC 4216110. PMID 25159147. doi:10.1016/j.celrep.2014.07.045.
- ↑ Stern-Ginossar N. , Ingolia NT. (2015). «Ribosome Profiling as a Tool to Decipher Viral Complexity». Annual Review of Virology 2 (1): 335-49. PMID 26958919. doi:10.1146/annurev-virology-100114-054854.
- ↑ «sORFs.org: repository of small ORFs identified by ribosome profiling». sorfs.org (en inglés). Consultado el 14 de diciembre de 2018.
- ↑ Olexiouk V, Crappé J, Verbruggen S, Verhegen K, Martens L, Menschaert G. (2016). «sORFs.org: a repository of small ORFs identified by ribosome profiling». Nucleic Acids Research 44 (D1): D324-329. PMC 4702841. PMID 26527729. doi:10.1093/nar/gkv1175.
- ↑ «ARA-PEPs: A Repository of putative sORF-encoded peptides in Arabidopsis thaliana». www.biw.kuleuven.be. Consultado el 14 de diciembre de 2018.
- ↑ Hazarika RR, De Coninck B, Yamamoto LR, Martin LR, Cammue BP, van Noort V. (2017). «ARA-PEPs: a repository of putative sORF-encoded peptides in Arabidopsis thaliana». BMC Bioinformatics 18 (1): 37. PMC 5240266. PMID 28095775. doi:10.1186/s12859-016-1458-y.
- ↑ «SmProt: a database of small proteins encoded by annotated coding and non-coding RNA loci». bioinfo.ibp.ac.cn. Consultado el 14 de diciembre de 2018.
- ↑ Hao Y, Zhang L, Niu Y, Cai T, Luo J, He S, Zhang B, Zhang D, Qin Y, Yang F, Chen R. (2018). «SmProt: a database of small proteins encoded by annotated coding and non-coding RNA loci». Briefings in Bioinformatics 19 (4): 636-643. PMID 28137767. doi:10.1093/bib/bbx005.
- ↑ Hemm MR, Paul BJ, Schneider TD, Storz G, Rudd KE. (2008). «Small membrane proteins found by comparative genomics and ribosome binding site models». Molecular Microbiology 70 (6): 1487-501. PMC 2614699. PMID 19121005. doi:10.1111/j.1365-2958.2008.06495.x.
- ↑ Wang R, Braughton KR, Kretschmer D, Bach TH, Queck SY, Li M, Kennedy AD, Dorward DW, Klebanoff SJ, Peschel A, DeLeo FR, Otto M. (2007). «Identification of novel cytolytic peptides as key virulence determinants for community-associated MRSA». Nature Medicine 13 (12): 1510-1514. PMID 17994102. doi:10.1038/nm1656.
- ↑ Hemm MR, Paul BJ, Miranda-Ríos J, Zhang A, Soltanzad N, Storz G. (2010). «Small stress response proteins in Escherichia coli: proteins missed by classical proteomic studies». Journal of Bacteriology 192 (1): 46-58. PMC 2798279. PMID 19734316. doi:10.1128/jb.00872-09.
- ↑ Casson SA, Chilley PM, Topping JF, Evans IM, Souter MA, Lindsey K. (2002). «The POLARIS gene of Arabidopsis encodes a predicted peptide required for correct root growth and leaf vascular patterning». The Plant Cell 14 (8): 1705-1721. PMC 151460. PMID 12172017. doi:10.1105/tpc.002618.
- ↑ Chilley PM, Casson SA, Tarkowski P, Hawkins N, Wang KL, Hussey PJ, Beale M, Ecker JR, Sandberg GK, Lindsey K. (2006). «The POLARIS peptide of Arabidopsis regulates auxin transport and root growth via effects on ethylene signaling». The Plant Cell 18 (11): 3058-3072. PMC 1693943. PMID 17138700. doi:10.1105/tpc.106.040790.
- ↑ Liu J, Mehdi S, Topping J, Friml J, Lindsey K. (2013). «Interaction of PLS and PIN and hormonal crosstalk in Arabidopsis root development». Frontiers in Plant Science 4: 75. PMC 3617403. PMID 23577016. doi:10.3389/fpls.2013.00075.
- ↑ Narita NN, Moore S, Horiguchi G, Kubo M, Demura T, Fukuda H, Goodrich J, Tsukaya H. (2004). «Overexpression of a novel small peptide ROTUNDIFOLIA4 decreases cell proliferation and alters leaf shape in Arabidopsis thaliana». The Plant Journal 38 (4): 699-713. PMID 15125775. doi:10.1111/j.1365-313x.2004.02078.x.
- ↑ Frank MJ. , Smith LG. (2002). «A small, novel protein highly conserved in plants and animals promotes the polarized growth and division of maize leaf epidermal cells». Current Biology 12 (10): 849-853. Bibcode:2002CBio...12..849F. PMID 12015123. doi:10.1016/s0960-9822(02)00819-9.
- ↑ Wang D, Li C, Zhao Q, Zhao L, Wang M, Zhu D, Ao G, Yu J. (2009). «Zm401p10, encoded by an anther-specific gene with short open reading frames, is essential for tapetum degeneration and anther development in maize». Functional Plant Biology 36 (1): 73-85. PMID 32688629. doi:10.1071/fp08154.
- ↑ Dong X, Wang D, Liu P, Li C, Zhao Q, Zhu D, Yu J. (2013). «Zm908p11, encoded by a short open reading frame (sORF) gene, functions in pollen tube growth as a profilin ligand in maize». Journal of Experimental Botany 64 (8): 2359-2372. PMC 3654424. PMID 23676884. doi:10.1093/jxb/ert093.
- ↑ Kondo T, Plaza S, Zanet J, Benrabah E, Valenti P, Hashimoto Y, Kobayashi S, Payre F, Kageyama Y. (2010). «Small peptides switch the transcriptional activity of Shavenbaby during Drosophila embryogenesis». Science 329 (5989): 336-339. Bibcode:2010Sci...329..336K. PMID 20647469. doi:10.1126/science.1188158.
- ↑ a b c Chng SC, Ho L, Tian J, Reversade B. (2013). «ELABELA: a hormone essential for heart development signals via the apelin receptor». Developmental Cell 27 (6): 672-680. PMID 24316148. doi:10.1016/j.devcel.2013.11.002.
- ↑ Pauli A, Norris ML, Valen E, Chew GL, Gagnon JA, Zimmerman S, Mitchell A, Ma J, Dubrulle J, Reyon D, Tsai SQ, Joung JK, Saghatelian A, Schier AF. (2014). «Toddler: an embryonic signal that promotes cell movement via Apelin receptors». Science 343 (6172): 1248636. PMC 4107353. PMID 24407481. doi:10.1126/science.1248636.
- ↑ Deshwar, Ashish R.; Chng, Serene C.; Ho, Lena; Reversade, Bruno; Scott, Ian C. (2016). «The Apelin receptor enhances Nodal/TGFβ signaling to ensure proper cardiac development». En Robertson, Elizabeth, ed. eLife 5: e13758. ISSN 2050-084X. PMC 4859801. PMID 27077952. doi:10.7554/eLife.13758.
- ↑ Scott, Ian C.; Masri, Bernard; D'Amico, Leonard A.; Jin, Suk-Won; Jungblut, Benno; Wehman, Ann M.; Baier, Herwig; Audigier, Yves et al. (2007). «The g protein-coupled receptor agtrl1b regulates early development of myocardial progenitors». Developmental Cell 12 (3): 403-413. ISSN 1534-5807. PMID 17336906. doi:10.1016/j.devcel.2007.01.012.
- ↑ D'Lima NG, Ma J, Winkler L, Chu Q, Loh KH, Corpuz EO, Budnik BA, Lykke-Andersen J, Saghatelian A, Slavoff SA. (2017). «A human microprotein that interacts with the mRNA decapping complex». Nature Chemical Biology 13 (2): 174-180. PMC 5247292. PMID 27918561. doi:10.1038/nchembio.2249.
- ↑ Ho, Lena; Tan, Shawn Y. X.; Wee, Sheena; Wu, Yixuan; Tan, Sam J. C.; Ramakrishna, Navin B.; Chng, Serene C.; Nama, Srikanth et al. (2015). «ELABELA Is an Endogenous Growth Factor that Sustains hESC Self-Renewal via the PI3K/AKT Pathway». Cell Stem Cell 17 (4): 435-447. ISSN 1875-9777. PMID 26387754. doi:10.1016/j.stem.2015.08.010.
- ↑ Slavoff SA, Heo J, Budnik BA, Hanakahi LA, Saghatelian A. (2014). «A human short open reading frame (sORF)-encoded polypeptide that stimulates DNA end joining». The Journal of Biological Chemistry 289 (16): 10950-10957. PMC 4036235. PMID 24610814. doi:10.1074/jbc.c113.533968.
- ↑ Guo B, Zhai D, Cabezas E, Welsh K, Nouraini S, Satterthwait AC, Reed JC. (2003). «Humanin peptide suppresses apoptosis by interfering with Bax activation». Nature 423 (6938): 456-461. Bibcode:2003Natur.423..456G. PMID 12732850. doi:10.1038/nature01627.
- ↑ Matsumoto A, Pasut A, Matsumoto M, Yamashita R, Fung J, Monteleone E, Saghatelian A, Nakayama KI, Clohessy JG, Pandolfi PP. (2017). «mTORC1 and muscle regeneration are regulated by the LINC00961-encoded SPAR polypeptide». Nature 541 (7636): 228-232. Bibcode:2017Natur.541..228M. PMID 28024296. doi:10.1038/nature21034.
