Pinacol
| Pinacol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2,3-dimetilbutano-2,3-diol | ||
| General | ||
| Otros nombres |
1,1,2,2-tetrametiletilenglicol 2,3-dihidroxi-2,3-dimetilbutano 2,3-dimetil-2,3-butanodiol | |
| Fórmula semidesarrollada | CH3-C(CH3)(OH)-C(CH3)(OH)-CH3 | |
| Fórmula molecular | C6H14O2 | |
| Identificadores | ||
| Número CAS | 76-09-5[1] | |
| ChEBI | 131185 | |
| ChEMBL | CHEMBL3289669 | |
| ChemSpider | 21109330 | |
| PubChem | 6425 | |
| UNII | 527QE7I5CO | |
|
CC(C)(C(C)(C)O)O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Olor | Leñoso, terroso, pachulí, pan caliente | |
| Densidad | 967 kg/m³; 0,967 g/cm³ | |
| Masa molar | 11 817 g/mol | |
| Punto de fusión | 42 °C (315 K) | |
| Punto de ebullición | 172 °C (445 K) | |
| Presión de vapor | 0,4 ± 0,7 mmHg | |
| Índice de refracción (nD) | 1,4426 | |
| Propiedades químicas | ||
| Solubilidad en agua | 3,5 × 104 mg/L | |
| Solubilidad | Etanol | |
| log P | -0,29 | |
| Familia | Alcohol | |
| Peligrosidad | ||
| Punto de inflamabilidad | 350,25 K (77 °C) | |
| Riesgos | ||
| LD50 | 3 380 mg/kg | |
| Compuestos relacionados | ||
| alcoholes | 2,3-dimetil-2-butanol | |
| dioles |
2-metil-2,5-pentanodiol 2,3-butanodiol | |
| polioles |
Trimetilolpropano 3-metil-1,3,5-pentanotriol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El pinacol, llamado también 2,3-dimetilbutano-2,3-diol o 1,1,2,2-tetrametiletilenglicol, es un alcohol de fórmula molecular C6H14O2. Es isómero de posición del 1,6-hexanodiol pero, a diferencia de este, es un diol vecinal cuyos dos grupos funcionales hidroxilo se encuentran en átomos de carbono adyacentes.
Propiedades físicas y químicas[editar]
El pinacol es un sólido blanco cuyo olor ha sido descrito como leñoso, terroso y pachulí.[2] Tiene su punto de fusión a 40 - 43 °C y su punto de ebullición a 172 °C. Posee una densidad ligeramente inferior a la del agua, 0,967 g/cm³.[3][4][5] Es soluble en agua caliente, alcohol y éter dietílico.[6]
Es un compuesto estable aunque combustible. Es incompatible con agentes oxidantes fuertes, bases fuertes y ácidos fuertes.[7]
Síntesis y usos[editar]
El pinacol se puede producir por reacción de acoplamiento pinacólica a partir de la acetona:[8]
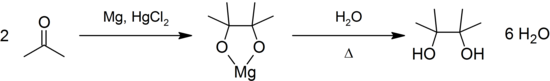
Otra ruta de síntesis del pinacol es por dihidroxilación asimétrica de Sharpless de tetrametiletileno, empleando osmio como catalizador a pH 12;[9] el rendimiento de esta reacción es del 99%.[7] Asimismo, la hidrogenación de 4,4,5,5-tetrametil-1,3-dioxolan-2-ona, utilizando (PNP)RuII como catalizador, permite obtener pinacol además de metanol.[10]
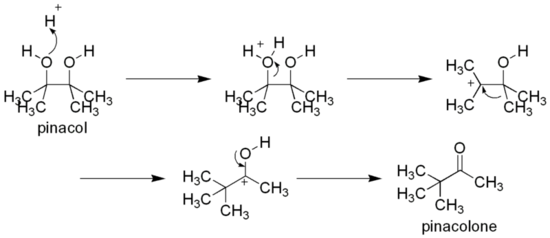
Como diol vecinal, el pinacol puede reordenarse a pinacolona por trasposición pinacólica, por ejemplo por calentamiento con ácido sulfúrico:[11]
Por otra parte, el pinacol puede usarse con borano y tricloruro de boro para producir productos intermedios sintéticos como pinacolborano, bis(pinacolato)diboro[12] y pinacolcloroborano. Además, juega un papel importante como intermediario en la elaboración de compuestos biológicamente activos como agentes antivirales, antibacterianos, antifúngicos y antituberculosis.[6] Por otra parte, se ha propuesto su empleo para la producción sostenible de o-xileno en un proceso en dos pasos que implica, en primera instancia, la deshidratación de pinacol a 2,3-dimetilbutadieno en cloruro de 1-etil-3-metilimidazolio, actuando como catalizador ácido fosfotúngstico; en segunda instancia, el o-xileno se forma por una reacción de Diels-Alder entre el 2,3-dimetilbutadieno obtenido en el primer paso y acroleína.[13]
En la industria alimentaria el pinacol se puede encontrar en la leche desnatada y en la leche en polvo.[14]
Precauciones[editar]
Este compuesto es inflamable, siendo su punto de inflamabilidad 77 °C. Su contacto puede provocar irritación en ojos, piel y aparato respiratorio.[15]
Véase también[editar]
Los siguientes compuestos son isómeros del pinacol:
- 1,2-hexanodiol
- 1,6-hexanodiol
- 2,5-hexanodiol
- 3,4-hexanodiol
- 2-metil-2,4-pentanodiol
- 2-propilpropano-1,3-diol
Referencias[editar]
- ↑ Número CAS
- ↑ Pinacol (TGSC Information System)
- ↑ Pinacol (Chemical Book)
- ↑ Pinacol Archivado el 19 de junio de 2015 en Wayback Machine. (ChemSpider)
- ↑ Pinacol (PubChem)
- ↑ a b B25006 Pinacol, 99% (Alfa Aesar)
- ↑ a b 2,3-dimethylbutane-2,3-diol (Molbase)
- ↑ Roger Adams and E. W. Adams. "Pinacol Hydrate". Org. Synth.; Coll. Vol. 1: 459.
- ↑ Mehltretter, D.; Sundermeier, B. (2000). «An improved version of the Sharpless asymmetric dihydroxylation». Tetrahedron Letters 41 (42): 8083-8087. Consultado el 23 de septiembre de 2018.
- ↑ Hang, Z.; Rong, L.; Wu, J.; Zhang, L.; Wang, Z; Ding, K. (2012). «Catalytic Hydrogenation of Cyclic Carbonates: A Practical Approach from CO2 and Epoxides to Methanol and Diols». Angewandte Chemie - International Edition 51 (52): 13041-13045. Consultado el 23 de septiembre de 2018.
- ↑ G. A. Hill and E. W. Flosdorf (1941). "Pinacolone". Org. Synth.; Coll. Vol. 1: 462.
- ↑ Tatsuo Ishiyama, Miki Murata, Taka-aki Ahiko, and Norio Miyaura (2004). "Bis(pinacolato)diboron". Org. Synth.; Coll. Vol. 10: 115.
- ↑ Hu, Y.; Li, N.; Li, G.; Wang, A.; Cong, Y.; Wang, X.; Zhang, T. (2017). «Sustainable Production of o-Xylene from Biomass-Derived Pinacol and Acrolein». ChemSusChem. 10 (4): 2880-2885. Consultado el 23 de septiembre de 2018.
- ↑ Pinacol (TGSC)
- ↑ Pinacol Safety Sheet (ThermoFisher Scientific)
